Aulas QUIMICA da 11a classe modelos atómicos
NESTE artigo falaremos sobre a Evolução dos modelos atómicos
Evolução dos modelos atómicos
Dalton
O químico inglês John Dalton afirmava que : O átomo era a menor partícula que constituía a matéria. Em 1808, Dalton apresentou seu modelo atómico:
o átomo como minúscula esfera maciça, indivisível, impenetrável e indestrutível.
Para ele todos os átomos de um mesmo elemento químico são iguais, até mesmo as suas massas. Hoje, nota-se um equívoco pelo facto da existência dos isótopos, os quais são átomos de um mesmo elemento químico que possuem entre si massas diferentes.
O seu
modelo atómico também é conhecido como modelo
da bola de bilhar.
O modelo de Dalton resume-se do seguinte modo:
•
O
átomo é uma esfera (partícula) maciça, indivisível e indestrutível.
• Os átomos do mesmo elementos químicos são
idênticos.
• Nas reacções químicas, os átomos não são criados,
nem destruídos, somente se modificam as suas distribuições.
Thomson
Pensador os raios catódicos, o físico inglês J.J Thomson demostrou que os mesmos podiam ser interpretados como sendo um feixe de partículas carregadas de energia eléctrica negativa, as quais firam chamadas de electrões .
Utilizando campos magnéticos e eléctricos, Thomson conseguiu determinar a relação entre a carga e a massa do electrão.
Ele concluiu que os electrões ( raios catódicos ) deveriam ser constituintes de todo o tipo de matéria pois observou que a relação carga ⁄ massa do era a mesma para qualquer gás que fosse colocado na ampola de Crooker ( tudo de vidro rarefeito no qual se fazem descargas eléctricas em campos eléctricos e magnéticos ).
Com base nas suas
conclusões, Thomson colocou por terra o modelo do átomo indivisível e
apresentou seu modelo, conhecido também como o modem de pudim com passas.
Thomson no seu modelo afirma:
• Os átomos
dispõe de estrutura esférica carregada positivamente ( que designou de ‹‹pudim ››
).
• Na esfera electropositiva encontra-se partículas com carga negativa, os electrões ( a que designou passas).
Rutherford
O modelo atómico de Rutherford é baseado nos
resultados de experiencia que Rutherford e os seus colaboradores realizaram:
bombardeamento de uma lâmina muito fina (delgada ) de ouro (Au) com partículas
alfa ( que eram positivas).
Experiência de Rutherford
Nesta experiência, uma fina lâmina de ouro é
bombardeada com partículas ![]() ( alfa) que são emitidas por um elemento radioactivo. Por trás dessa
lâmina de ouro há anteparo recoberto de sulfureto de zinco, que tem a
propriedade de detectar as partículas
( alfa) que são emitidas por um elemento radioactivo. Por trás dessa
lâmina de ouro há anteparo recoberto de sulfureto de zinco, que tem a
propriedade de detectar as partículas ![]() , pois torna-se
fluorescente sob o seu impacto.
, pois torna-se
fluorescente sob o seu impacto.
Resultados da Experiência
Rutherford verificou que:
1.̊A maior parte das partículas ![]() não se desvia.
não se desvia.
2. Poucas sofrem um desvio brusco.
3. Um número reduzido retrocede violentamente.
Conclusões
de experiencia:
a) O átomo é quase
inteiramente constituído por espaços vazios. Esta conclusão advém do facto de
que a maioria das partículas atravessa a lâmina de ouro sem se desviar.
b) O átomo apresenta um pequeno núcleo relativamente maciço, com
o qual apenas um numero reduzido de partículas ![]() chocas, sofrendo retrocesso.
chocas, sofrendo retrocesso.
c) Em tal núcleo concentra-se a massa atómica.
d) Como já se sabia de que partículas ![]() eram carregadas positivamente, conclui-se que
os desvios dessas partículas decorriam da repulsão pelo núcleo, que seria
também positivo.
eram carregadas positivamente, conclui-se que
os desvios dessas partículas decorriam da repulsão pelo núcleo, que seria
também positivo.
e) O reduzido número de partículas ![]() desviadas permitiu que se calculasse a
proporção entre dimensões do núcleo em relação ao átomo.
desviadas permitiu que se calculasse a
proporção entre dimensões do núcleo em relação ao átomo.
O núcleo é muito
pequeno em relação ao diâmetro do átomo. Essa proporção vária de 1/10 000 até
1/100 000. Finalmente, Rutherford admitiu que os electrões estariam girar em
órbitas circulares.
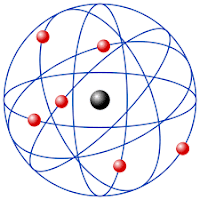
A noção do modelo atómico de Rutherford, resumida, é:
• A matéria é
constituída por pequenas partículas chamadas átomos que apresentam duas
regiões: o núcleo e a electrosfera.
• O núcleo apresenta
pequenas dimensões e grande massa, concentrando toda carga positiva do átomo.
• Na electrosfera
giram cargas negativas, os electrões, tal como os planetas à volta do sol- modelo planetário.
Rutherford e os seus colaboradores verificam que, para aproximadamente 10 000 partículas alfa que indica na lâmina de ouro, apenas uma era desviada ou reflectida.
Deste modo, concluíram que o raio do átomo era 10 000 vezes maior que o raio do núcleo. Surgiu então, 1988, o modelo do átomo nucleado, conhecido como o modelo planetário do átomo:
o átomo é constituído por um núcleo central positivo, muito pequeno em relação ao tamanho total do átomo, porem com grande massa.
Em
seu redor localizam-se os electrões com carga negativa ( compondo a enorme
electrosfera) e com pequena massa, que neutralizam o átomo.
Bohr
Em 1913, o físico dinamarquês Niels Bohr, após profundos do modelo de Rutherford, constatou dois
equívocos:
• Uma carga negativa, colocada em movimento em redor de uma
carga positiva estacionária, adquire movimento em espiral em direcção à carga
positiva, acabando por colidir com ela.
•Uma carga negativa em movimento erradia ( perde ) energia constantemente , emitindo radiação .
Porem, sabe-se que o átomo no seu estado normal não emite radiação.
Bohr conseguiu solucionar os equívocos cometidos por Rutherford
baseando-se na seguinte ideia:
• Um electrão, num átomo, adquire apenas certas energias, e cada energia é representada por uma órbita definida, particular.
Se o electrão recebe energia ele pula para uma outra órbita mais afastada do núcleo. Pode ocorrer no electrão perda de energia por irradiação e, sendo assim, o electrão cai para uma órbita mias próxima do núcleo.
Todavia, o electrão não pode ficar entre
duas órbitas estável (órbita não especifica). Conclui-se, então, que : quando maior for a energia do electrão, mais
afastado ele esta dentro do núcleo,
ou seja, um electrão só pode estar em movimento em redor do núcleo se estiver em
órbitas específicas, definidas.
O modelo de Bohr resume-se:
• Os electrões giram em redor do núcleo, em regiões bem
definidas, onde não há ganhi e nem perda de energia. São chamados estados estacionários.
• O estado estacionário menos energético chama-se estado
fundamental.
Aos restantes estados dá-se o nome de estados excitados, os quais são instáveis.
• Não há emissão nem absorção de energia enquanto os electrões
estiverem em movimento numa órbita.
• Quando um electrão recebe energia, ele poderá passar para uma órbita mais externa, ou seja, mais afastada do núcleo.
No entanto, essa órbita
é uma posição instável e o electrão tende a voltar à órbita original. Neste
retorno, o electrão emite energia.
• Para um electrão é mais fácil mudar de órbita ou até mesmo sair do átomo, quanto mais longe estiver do núcleo.
Cada órbita é caracterizada
por um número ɳ bem definido que recebeu o nome de número quântico principal. Segundo Bohr, para a primeiro ɳ=1, para a segunda ɳ=2, etc.
BIBLIOGRAFIA:
Livro de QUIMICA da 11ā classe BAIXAR
AUTORES: Maneca Matusse & Margarida
Veiga,Maputo,Abril de 2015, 2ā edição,2ā tiragem.





Enviar um comentário
0 Comentários
Deixe o seu comentário aqui